Vamos a realizar una serie de mezclas y disoluciones
Material
- Agua (solvente)
- Soluto 1: sal (sal gruesa para que tengan la oportunidad de practicar con el mortero)
- Soluto 2: Azúcar (en terrones para usar el mortero)
- Arena
- Arena
Procedimiento
En un vaso de precipitado verterán aproximadamente 100ml de agua fría y añadirán el azúcar hasta la saturación. Si se la presentamos en terrones deberán machacarlas primero
Lo mismo con la sal.
Anotarán la masa de sal y azúcar necesaria
Anotarán la masa de sal y azúcar necesaria
Harán lo mismo en otros vasos, pero ahora utilizando agua caliente.
¿Qué sucede?
Hemos conseguido una mezcla homogénea.
En el agua caliente se disuelve mayor cantidad de soluto (sal o azúcar).
Otras mezclas:
2º Arena y agua
Logramos mezclar la arena, pero ocurre algo distinto aumenta el nivel del agua por desplazamiento del agua al ser empujada por la arena que introducimos;
mientras que con la sal el volumen total de la mezcla era igual al inicial del agua, a no ser que hubiéramos sobrepasado el índice de saturación.
En cuanto a la azúcar sube un poco el nivel porque las ´moléculas de azúcar son de mayor tamaño que las de sal
Hemos conseguido una mezcla homogénea.
En el agua caliente se disuelve mayor cantidad de soluto (sal o azúcar).
Otras mezclas:
2º Arena y agua
Logramos mezclar la arena, pero ocurre algo distinto aumenta el nivel del agua por desplazamiento del agua al ser empujada por la arena que introducimos;
mientras que con la sal el volumen total de la mezcla era igual al inicial del agua, a no ser que hubiéramos sobrepasado el índice de saturación.
En cuanto a la azúcar sube un poco el nivel porque las ´moléculas de azúcar son de mayor tamaño que las de sal
Explicación
Las moléculas de sal son pequeñas y se disponen entre los huecos de las moléculas de agua, las de azúcar son mas grandes y no caben totalmente en los huecos o cavidades que quedan entre las moléculas de agua por eso aumenta ligeramente el volumen.
La arena es sólida y sus partículas están estrechamente ligadas, no pueden separarse, además son tan grandes que no caben en los huecos.
Imagínate que el agua es una casa con habitaciones y la sal son las personas que viven en él, el volumen del edificio no aumenta aunque haya más o menos personas (sal) dentro.
Las moléculas de sal son pequeñas y se disponen entre los huecos de las moléculas de agua, las de azúcar son mas grandes y no caben totalmente en los huecos o cavidades que quedan entre las moléculas de agua por eso aumenta ligeramente el volumen.
La arena es sólida y sus partículas están estrechamente ligadas, no pueden separarse, además son tan grandes que no caben en los huecos.
Imagínate que el agua es una casa con habitaciones y la sal son las personas que viven en él, el volumen del edificio no aumenta aunque haya más o menos personas (sal) dentro.
A continuación: Acceder al experimento separación de mezclas sal-agua, azúcar-agua, y arena-agua. Evaporación, filtración,..
PROPIEDADES DEL AGUA
El agua presenta las siguientes propiedades físico-químicas:
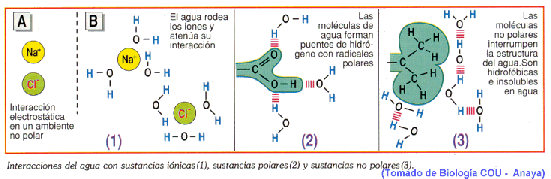
a) Acción disolvente.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
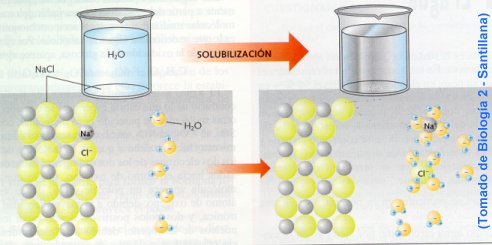
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías
de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos.
b) Fuerza de cohesión entre sus moléculas.
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un liquido casi incompresible.
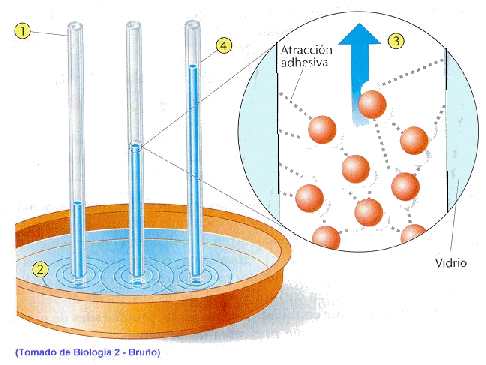
c) Elevada fuerza de adhesión.
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
d) Gran calor específico. El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciente más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de proteccción para las moléculas orgánicas en los cambios bruscos de temperatura.
e) Elevado calor de vaporización.
A 20ºC se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
A 20ºC se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
f) Elevada constante dieléctrica.
Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
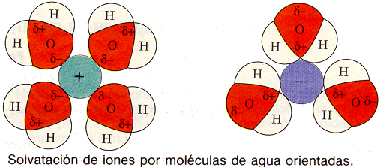
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
g) Bajo grado de ionización. De cada 107 de moléculas de agua, sólo una se encuentra ionizada.
H2O  H3O+ + OH-
H3O+ + OH-
Esto explica que la concentración de iones hidronio (H3O+) y de los iones hidroxilo (OH-) sea muy baja. Dado los bajos niveles de H3O+ y de OH-, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente.







