1ª Experiencia. "Soldamos dos cubitos de hielo".
Material
- 2 cubitos de hielo
- Trapo de cocina
Procedimiento
Cogemos dos cubitos de hielo del congelador con un trapo de cocina. Ponlos en contacto por una superficie plana.
Hacemos presión con las manos protegidas por el paño de cocina durante un minuto, aproximadamente.
¿Qué sucede?
Los cubitos se unen.


2ª Experiencia: Soldamos un hilo a un cubito.
Material
- vaso
- agua fría
- un hilo o cuerda fina
- un cubito de hielo
Procedimiento
Llenamos un vaso de agua fría, sumergimos la parte central del hilo en el agua y lo sacamos.
Ponemos un cubito de hielo sobre el agua del vaso: el hielo flotará.
Ponemos el trozo de hilo mojado sobre el hielo de forma que los extremos del hilo salgan del vaso, (parte del hilo o la cuerda deberá descansar sobre el hielo).
Vertimos sal fina sobre la parte del hilo que descansa sobre el hielo, esperamos un minuto o más.
Al cabo de un tiempo cogemos los extremos del hilo uno con cada mano y los elevamos.
¿Qué sucede?
Hemos conseguido levantar el hilo y el cubito se ha soldado al hilo.
3ª Experiencia. Fusión por hielo- atravesamos un hielo sin cortarlo".
¿Qué queremos hacer?
Atravesar con un hilo un bloque de hielo sin cortarlo.
Material
- un hilo de acero
- 2 pesas de 300g cada una
- un bloque de hielo
Procedimiento
Situamos un hilo sobre un bloque de hielo y dos pesas una a cada extremo.
Esperamos un tiempo.
¿Qué sucede?
El hilo de acero atraviesa el bloque, y este no se corta.
Explicación
La presión ejercida por las pesas hace que el punto de fusión del agua disminuya y se funda a menos de 0º y el hilo es capaz de atravesarlo, el agua de la parte superior al no sufrir presión vuelve a solidificarse.
Explicación
La temperatura de congelación es función de la presión en los cambios de fase de un solo componente
La termodinámica del cambio de estado del hielo a agua nos dice que el punto de fusión decrece cuando la presión aumenta. En condiciones normales el hielo se funde y congela a 0ºC, pero esto no ocurre cuando se eleva la presión ejercida sobre él. El descenso del punto de congelación o fusión con la presión que se ejerce sobre el hielo es importantísimo en ciertos acontecimientos terrestres y planetas fríos con agua-hielo.
Cuando presionamos los dos cubitos de hielo a una temperatura constante, estos se funden ya que aumentamos la presión con nuestras manos sobre la superficie de contacto. En esos momentos se forma una pequeña capita de agua entre las superficies de contacto que no se congela al descender el punto de congelación.
Al liberar los cubitos de hielo de la presión ejercida por nuestras manos, volvemos a las condiciones normales e iniciales: la presión disminuye, volviendo a congelarse la capa de agua pero esta vez a la temperatura de 0ºC, como se estaba inicialmente. Cuando presionas el hielo se funde y cuando dejas de presionar el agua vuelve a congelarse uniendo ambos cubos de hielo por la pequeña cantidad de agua subfundida que se generó.
Un poco de teoría. La ecuación de Clapeyron
El punto de congelación disminuye con la presión en un sistema en equilibrio agua-hielo. Este hecho repercute en muchas actividades humanas y sistemas, pasando a veces desapercibidas ante nuestros ojos:
- Una persona patinando sobre una superficie helada a una temperatura próxima e inferior a 0ºC ejerce con sus patines una presión altísima: P=F/S. Siendo F su peso y S la superficie fina de las cuchillas de los patines (S es muy, muy pequeña). En estas condiciones cuando el patinador se desliza sobre el hielo, éste se funde permitiendo el agua líquida que se desplaza con mayor facilidad. Una vez que el patinador ha pasado por la zona, está se vuelve a congelar.
- Pensemos en un glaciar en zonas relativamente muy frías. Mientras que el hielo de su superficie no se congela, en la base de los glaciares la presión es altísima debido al propio peso del hielo del glaciar. En estas condiciones, el derretimiento tiene lugar en su base, lo cual que facilita su deslazamiento.
- En ciertas zonas profundas de la Antártida debajo de capas de hielo se han encontrado lagos de agua donde se ha desarrollado cierto tipo de vida. La altísima presión sobre dichos lagos profundos de la capa de hielo antártida puede hacer descender tanto el punto de congelación que el agua se encuentre en fase líquida.
- Estos mismos hechos se pueden dar en otros planetas alejados del sol o de estrellas donde el hielo reinante puede albergar lagos profundos cercanos a zonas cálidas del interior de los planetas pudiendo albergar cierto tipo de vida primigenia.
Efecto de la presión y de la temperatura
La ecuación de Clapeyron permite calcular la pendiente de la línea de equilibrio entre dos fases un sistema de un componente. Esta ecuación es una de las fundamentales de la Termodinámica, y rige las transiciones de fase de una sustancia:
En la cual p es la presión, T es la temperatura en la que ocurre la transición, 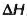 es el cambio de contenido en calor y
es el cambio de contenido en calor y 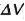 es el cambio de volumen que se ha realizado durante la transición o cambio de fase.
es el cambio de volumen que se ha realizado durante la transición o cambio de fase.
Esta ecuación nos relaciona las variaciones de presión y de temperatura fusión-solidificación con los calores puestos en juego en el cambio de fase. El valor y signo del segundo miembro nos dice cómo varía los cambios de la temperatura de cambio de fase cuando modificamos la presión en dicha transformación.
Si nos centramos en los cambios de fase líquido-sólido, la ecuación tomará la forma:
dp/dT= H/T(vl-vs)
Siendo vl y vs los volúmenes específicos de la fase líquida y sólida, respectivamente, y H el calor latente puesto en juego para realizar dicho cambio de fase. En general, el volumen específico de los líquidos es mayor que el de los sólidos ya que se dilatan al fundirse. El segundo miembro suele ser positivo y la pendiente (dp/dT) de la curva P-T en el cambio de fase suele ser positiva que se traduce en:
Un aumento de presión en la fusión, o paso de sólido a líquido, debe corresponderse con un aumento de la temperatura de fusión. A mayor presión a la que esta sometido un sólido, en general, le corresponderá un aumento en la temperatura para que dicho sólido pase a líquido. El aumento de la presión tenderá a mantener a las partículas sólidas más juntas y el paso a líquido se hará aumentando más la temperatura.
El caso del agua-hielo
Una vez más el agua se sale de estas normas ya que el volumen específico del hielo es mayor que el del agua y el segundo miembro se hace negativo. De esta forma la dp/dT es negativa: cuando aumentamos la presión sobre el hielo, la temperatura de fusión decrece.
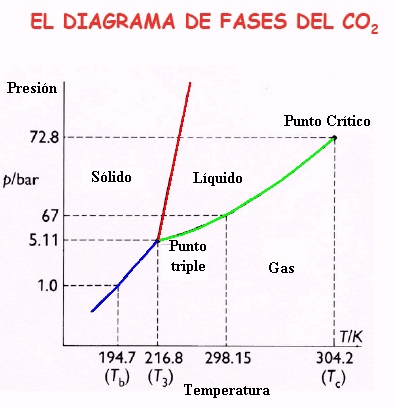
Estos hechos se ven muy bien en los diagramas de cambio de fases de las diferentes sustancias ya que cada uno posee la suya propia. Si construimos un diagrama de presión-Temperatura donde coexista una sustancia en fases diferentes tendríamos un conjunto de curvas relativas a los estados de equilibrio sólido-líquido (rojo), líquido-gas (verde) y gas-sólido (azul). En termodinámica se denomina diagrama de fase o diagrama de cambio de estado a la representación gráfica de las fronteras entre diferentes estados de la materia, generalmente en función de la presión y la temperatura.
El del CO2 es el que presentamos a continuación. Debemos observar que las pendientes de las curvas coloreadas (dp/dT) son todas positivas, como en la mayoría de las sustancias. Si nos centramos en los cambios de fase sólido-liquido (línea roja) tenemos que la pendiente de la curva es positiva: un aumento de presión en el CO2 sólido tenderá a aumentar la temperatura de fusión necesaria para pasar a líquido.
Para el agua el diagrama de fase es este:
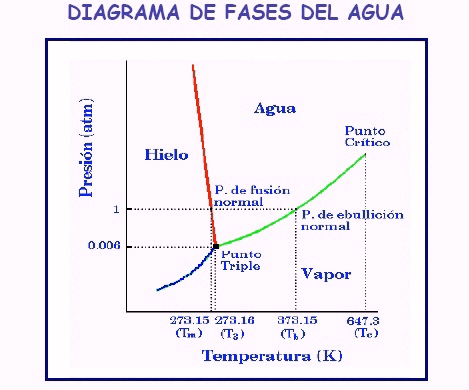
En condiciones normales, de 1 atmósfera de presión, la temperatura de fusión es de 0º C. Fijémonos que la curva hielo-agua posee una pendiente negativa (dp/dT). Por ello, un aumento en la presión en el hielo va acompañado de una disminución de la temperatura de fusión, es decir, el hielo se funde por compresión, al contrario de la mayoría de las sustancias que al comprimirlas se solidifican. Para grandes presiones el hielo se funde por debajo de los 0º C.
En resumidas cuentas, cuando presionas el hielo con las manos, aumentamos la presión, la temperatura de fusión disminuye haciendo que éste se funda en la zona de contacto de las dos superficies generando una capa fina de agua. Cuando dejamos de presionar el agua entre dichas superficie vuelve a congelarse uniendo los cubitos de hielos utilizados.
II parte del experimento
Cualquier sustancia disuelta en un disolvente tiende a disminuir el punto de congelación del disolvente. En el caso de la sal, está tiende a rebajar el punto de congelación del agua donde se disuelve, teóricamente, hasta los -16 ºC, dependiendo de la concentración de sal disuelta en agua. Por ejemplo, a un 5% de concentración de sal la temperatura de congelación desciende a los -3 ºC, si el porcentaje es del 10 % de sal, la temperatura de congelación del agua pasaría a -6 º C y no de 0º C; tanto más sal tengamos disuelta, más bajo será el punto de congelación de la disolución. En la vida real la sal común puede descender la temperatura de congelación del agua hasta los -9 ºC -10 ºC. Por este motivo se echa sal en el suelo en los momentos antes y durante las nevadas y evitar la formación de capas de hielo y nieve.
Por lo tanto, cuando echamos sal sobre la cuerda que descansa sobre el hielo, el punto de congelación desciende y el hielo se derrite. Al formarse agua, ésta diluye la sal poco a poco y va eliminando el efecto de disminución del punto de congelación, por lo que el hilo o la cuerda se congela al aumentar nuevamente el punto de congelación y pasar al valor de condiciones normales. La cuerda, el agua congelada y el cubito de hielo han quedado unidos entre si. Ahora podemos sacarlo del vaso de agua sin más que estirar de los extremos.
Por lo tanto, cuando echamos sal sobre la cuerda que descansa sobre el hielo, el punto de congelación desciende y el hielo se derrite. Al formarse agua, ésta diluye la sal poco a poco y va eliminando el efecto de disminución del punto de congelación, por lo que el hilo o la cuerda se congela al aumentar nuevamente el punto de congelación y pasar al valor de condiciones normales. La cuerda, el agua congelada y el cubito de hielo han quedado unidos entre si. Ahora podemos sacarlo del vaso de agua sin más que estirar de los extremos.


